큐라클 “당뇨병성 신증 신약 임상 2a상 성공적” 밝혀
▶ 유효성, 안전성, 우수한 치료효과 확인
▶ SGLT-2 억제제와는 분명한 차별성, 신장 섬유화까지 치료
▶ 치료제 시장 규모 확대 속 새 치료옵션으로 기대
[사진자료]
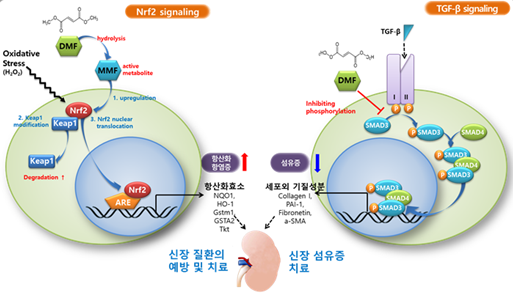
▶ 새로운 작용기전의 혁신 신약 CU01-1001
<2021-03-26>큐라클(대표이사 김명화, 박광락)은 당뇨병성 신증 치료제 CU01-1001 임상 2a상 Topline 결과 유효성, 안전성을 확인했으며 당뇨병성 신증과 관련된 복수의 평가지표에서 위약군 대비 우수한 치료효과를 확인했다고 26일 밝혔다.
이번 임상시험은 영남대학교병원을 포함해 5개 병원에서 실시했다. 알부민뇨가 나타나는 제2형 당뇨병성 신증 환자 42명을 모집해 기존의 당뇨병 치료제(ACE 억제제 또는 ARB)를 유지하면서, 시험약 CU01-1001 또는 위약을 12주 동안 하루 2회 경구 투약하여 약동학적 분석 및 유효성, 안전성 평가를 진행했다.
통계 분석 결과, CU01-1001 투여군에서 사구체 여과율(eGFR, estimated Glomerular Filtration Rate)의 유의한 증가가 관찰되었다(60.60mL/min/1.73㎡에서 64.40 mL/min/1.73㎡, 변화량 3.80 mL/min/1.73㎡). 가장 빈번히 발생한 이상반응으로는 홍조(안면홍조 포함), 오심이 각각 18.18%, 13.64%의 비율로 나타났고, 중대한 약물이상반응은 1건도 관찰되지 않아 CU01-1001의 안전성과 내약성을 확인했다.
임상시험 총괄책임자인 영남대학교병원 내분비대사내과 원규장 교수는 “국내 제2형 당뇨병성 신증 환자의 사구체 여과율이 매년 평균 2.42mL/min/1.73㎡씩 떨어짐에도 불구하고 본 약제를 12주 투여 후에 3.80mL/min/1.73㎡ 증가가 관찰됐기 때문에 향후 본 약제가 제2형 당뇨병성 신증 환자들을 위한 새로운 치료 옵션이 될 것으로 기대된다. “고 전했다.
시장 분석업체 Global Data에 따르면 전세계 당뇨병성 신증 치료제 시장 규모는 2016년에서 2024년까지 평균 5.9% 성장해 2024년에는 38억 달러에 달할 것으로 예상되며, 미국, 영국 등 주요 7개국에서의 환자 수도 2016년 1,660만명에서 2022년 1,980만명으로 증가할 것으로 예상된다.
또한 현재 당뇨병성 신증 1차 치료제로 사용되고 있는 안지오텐신 전환효소억제제(angiotensin converting enzyme inhibitor)와 안지오텐신 II 수용체 차단제(angiotensin II receptor blocker)는 치료 효과가 미비하고 말기 신증질환 환자에는 적용이 불가능하기 때문에 새로운 치료약제에 대한 요구가 늘고 있다. 신규 기전의 신약이 출시된다면 높은 시장 점유율을 기대할 수 있다.
큐라클 김명화 대표는 “최근 각광을 받고 있는 SGLT-2 억제제가 긍정적인 심혈관 및 신기능 임상시험 결과를 보여줬으나, 10년 이상의 만성 대상 질환자인 경우, 신장 섬유화에 의한 신장기능이 매우 약화돼 있으며 만성적인 신장기능 저하는 신장 섬유화와 깊게 관련돼 있다.”고 밝혔다.
이어서 “현재 시장에 나와 있는 경구용 신섬유화 억제제는 없는 실정이다. CU01-1001은 직접적인 신섬유화 억제 효능을 동물실험에서 검증했기 때문에 SGLT-2 억제제와는 분명한 차별성을 갖는 약물이다. CU01-1001는 Nrf2를 활성화하면서 동시에 TGF-β/Smad를 억제하기 때문에 신장 섬유화까지 치료할 수 있는 새로운 작용기전의 혁신 신약이다. 미국 Biogen사의 다발성경화증치료제 “텍피데라”의 주성분 Dimethyl fumarate(DMF)를 Drug Repositioning(신약재창출) 방법을 이용하여 빠른 속도로 개발하고 있다.” 고 설명했다.
큐라클 강지혜 임상개발본부장은 “이번 2a 임상 결과에서 CU01-1001은 임상적으로 유의한 사구체여과율의 뚜렷한 개선과 단백뇨 증상 개선 효과를 보였다. 이번 결과는 국제학회와 저널에 발표할 계획이며, 추가적인 안전성 확인과 신장기능 회복 효과 입증을 위한 후기 임상시험도 2a 시험을 수행한 CRO디티앤사노메딕스와 준비하고 있다”고 전했다.
한편, 큐라클은 지난 2월 26일, 미국 FDA로부터 경구용 당뇨황반부종 신약 CU06-1004의 IND승인을 받아 4월부터 미국 임상 1상 시험에 박차를 가할 예정이다.
▣ 자료문의 : 큐라클 표정인 이사(070-4410-2347)
IR큐더스 조한경 책임(070-5068-6324)
본 게시물을 열람하는 이용자에게 있습니다.